EL AtOmo!!!!
((Luego de distintas discucines de este importante tema , en 1905 con la publicación de Einstein , las discusiones dejaron de ser realidad))
1.ModElO AtOmIcO De tHOmSoM..
<<<<>>
<
à La Radiactividad..
àRayos alfa poco penetrantes.
à Determinados por una lamina metalica.(rayos beta)
à rayos gamma necesitamos una pared de plomo para deteerlos.
2. El mOdElO AtOmIcO De RuThErFoRd.
3.LoS eSPeCtrOs.
C= longitud de onda x frecuencia
3.1 EspEcTrOs De eMiSioN: Los electrones emiten luz de color a esto se le llama espectro visible de emision.
3.2 EsPeCtrOs dE aBsOrCioN : Energia y luz absorbida por la materia.
4. HiPoTeSiS CuAnTiCa:
àHeinrich Rudolf Hertz descubrió el efecto fotoeléctrico (que fue explicado más adelante por Albert Einstein) cuando notó que un objeto cargado pierde su carga más fácilmente al ser iluminado por la luz ultravioleta.
à HipotEsIs dE pLaNk:
La aplicación conjugada del electromagnetismo y la mecánica ondulatoria auspició avances espectaculares en la física. En este contexto, el alemán Max Planck llegó en el año 1900 a una conclusión revolucionaria: la energía luminosa sólo puede ser múltiplo de un valor fundamental al que denominó cuanto. Era el nacimiento de la física cuántica
5. El eFeCTo fOtOeLeCtrIcO:
la idea de partículas discretas de luz podía explicar el efecto fotoeléctrico y la presencia de una frecuencia característica para cada material por debajo de la cual no se producía ningún efecto.
6.MoDeLo aToMiCo dE BoHr:
Las características del espectro de emisión de algunos elementos son claramente visibles a ojo descubierto cuando estos elementos son calentados.
7.MoDeLo aToMiCO AcTuAl:
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno y oxígeno

 y la densidad de corriente
y la densidad de corriente  satisfacen una
satisfacen una 
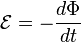
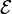 =
= 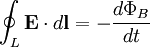










No hay comentarios:
Publicar un comentario